Категории
Сменить пароль!
Сброс пароля!


Сахарный диабет 2 типа (СД2) — хроническое заболевание, вызванное резистентностью к инсулину и дисфункцией β-клеток, — приводит к повышению уровня глюкозы в крови, который часто трудно контролировать с помощью изменения образа жизни и приема пероральных препаратов.
Добавление лобеглитазона к метформину и ситаглиптину обеспечивает мощную трехкомпонентную терапию, которая снижает уровень HbA1c на 1%, улучшает чувствительность тканей к инсулину и липидный профиль, предлагая безопасный и эффективный вариант для пациентов с неконтролируемой гликемией.
Сахарный диабет 2 типа (СД2) — хроническое заболевание, вызванное резистентностью к инсулину и дисфункцией β-клеток, — приводит к повышению уровня глюкозы в крови, который часто трудно контролировать с помощью изменения образа жизни и приема пероральных препаратов. Ранняя и эффективная комбинированная терапия имеет основополагающее значение для предотвращения осложнений и улучшения результатов лечения. Метформин по-прежнему остается стандартной терапией первой линии для лечения сахарного диабета 2 типа благодаря своей доказанной эффективности и доступности.
Ситаглиптин, первый ингибитор дипептидилпептидазы-4 (ДПП-4), имеет самые веские подтверждающие доказательства в своем классе препаратов. По сравнению с населением западных стран у представителей монголоидной расы обычно наблюдаются более выраженные дефекты секреции инсулина из-за сниженной массы и функции бета-клеток, что делает их более восприимчивыми к ингибиторам ДПП-4. По этой причине наиболее распространенной стратегией у пациентов в Корее является сочетание метформина с ингибитором ДПП-4. Тем не менее, поскольку двойная терапия часто обладает ограниченной долговременной эффективностью, а диабет имеет тенденцию к прогрессированию со временем, применение тройной пероральной терапии становится все более распространенным.
Тиазолидиндионы (ТЗД) повышают чувствительность тканей к инсулину, однако старые препараты этого класса вызывают опасения по поводу безопасности. Лобеглитазон, новый ТЗД, демонстрирует более выраженные эффекты и лучшую безопасность в доклинических и клинических исследованиях. Он помогает улучшить секрецию инсулина, снижает клеточный стресс и обладает противовоспалительными свойствами, что способствует защите функции β-клеток и улучшению гликемического контроля. Ранние клинические исследования показывают, что лобеглитазон безопасен и имеет меньше серьезных побочных эффектов по сравнению с другими ТЗД.
Благодаря этим преимуществам, лобеглитазон может стать полезным третьим препаратом в дополнение к метформину и ситаглиптину, особенно для азиатских пациентов, в том числе людей пожилого возраста и с отсутствием ожирения. Хотя в некоторых рекомендациях для трехкомпонентной терапии предпочтительны ингибиторы SGLT-2, ТЗД, такие как лобеглитазон, могут стать хорошей альтернативой. Однако исследований по добавлению ТЗД к двухкомпонентной терапии метформином и ингибиторами ДПП-4 недостаточно.
Цель исследования
В этом рандомизированном плацебо-контролируемом клиническом исследовании III фазы оценивалась эффективность и безопасность лобеглитазона в качестве дополнительной терапии к метформину и ситаглиптину у пациентов с сахарным диабетом 2 типа, у которых наблюдался недостаточный гликемический контроль при двухкомпонентной пероральной терапии в Корее.
Это 52-недельное исследование проводилось в 19 клинических центрах Республики Корея в период с апреля 2018 года по декабрь 2021 года в соответствии с Хельсинкской декларацией, рекомендациями по надлежащей клинической практике (GCP) и стандартами Международной конференции по гармонизации (ICH).
Критерии включения
В исследование включались
Критерии исключения
Извлечение данных
Результаты исследования
(а) Первичная конечная точка
(б) Вторичные конечные точки
(c) Результаты оценки безопасности
Данные и статистический анализ
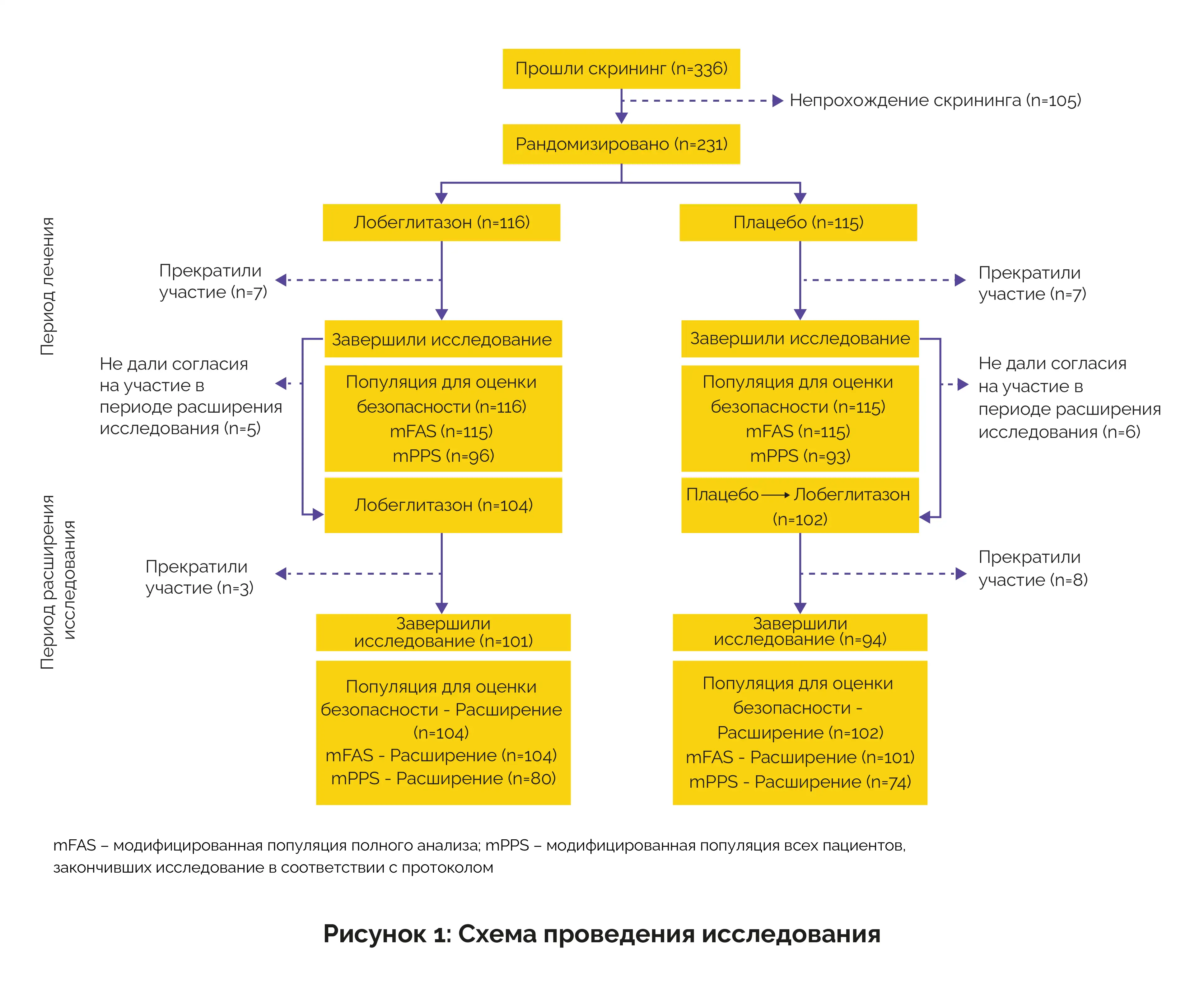
Основные результаты
В этом исследовании подчеркивается высокая эффективность лобеглитазона в качестве дополнительной терапии, обеспечивающей значительное снижение HbA1c на 1% за 24 недели, что превышает типичное снижение, наблюдаемое при использовании других комбинаций трехкомпонентной терапии. Положительные гликемические показатели сохранялись на протяжении 52 недель, наряду со значительными улучшениями в резистентности к инсулину и функции β-клеток, даже у пациентов с длительно текущим диабетом, не поддающимся адекватному контролю с помощью метформина и ингибиторов ДПП-4.
Устойчивое снижение подчеркивает эффективность лобеглитазона в снижении уровня глюкозы и подтверждает эффективность терапии ТЗД, продемонстрированную в предыдущих исследованиях, включая данные исследований реальной клинической практики, показывающие эффективность в течение 42 месяцев более чем у 2000 пациентов. Лобеглитазон продемонстрировал благоприятный профиль безопасности: наблюдались лишь незначительные отеки и контролируемое увеличение массы тела.
Кроме того, он положительно влияет на липидный обмен, снижая уровень мелких плотных ЛПНП и свободных жирных кислот, одновременно повышая уровень ХС-ЛПВП, что свидетельствует о потенциальной пользе для сердечно-сосудистой системы. Хотя результаты являются многообещающими, необходимы более длительные исследования для подтверждения устойчивой эффективности и безопасности. В целом лобеглитазон представляется ценным дополнением к схемам трехкомпонентной терапии, обеспечивающим эффективный гликемический контроль и улучшение метаболизма, что может способствовать улучшению долгосрочных результатов лечения сахарного диабета 2 типа.
Добавление лобеглитазона к комбинированной терапии метформином и ситаглиптином продемонстрировало стабильный гликемический контроль, улучшение показателей инсулиновой динамики и благоприятные изменения липидного профиля, что представляет собой хорошо переносимый и эффективный вариант лечения для пациентов с недостаточно контролируемым сахарным диабетом 2 типа
Diabetes, Obesity and Metabolism
Efficacy and safety of lobeglitazone added to metformin and sitagliptin combination therapy in patients with type 2 diabetes: A 52-week, multicentre, randomized, placebo-controlled, phase III clinical trial
Eun-Gyoung Hong и соавт.
Комментарии (0)