Категории
Сменить пароль!
Сброс пароля!


Экноглутид, новый агонист рецепторов ГПП-1, обеспечивает значительное снижение массы тела у взрослых пациентов с избыточной массой тела или ожирением, сохраняя при этом благоприятный профиль безопасности.
По результатам крупного исследования 3 фазы, проведенного в Китае, взрослые пациенты, страдающие ожирением или избыточной массой тела, потеряли до 13,2% массы тела после 40 недель лечения экспериментальным препаратом экноглутид.
Экноглутид, новый агонист рецепторов глюкагоноподобного пептида-1 (ГПП-1), действующий на циклический аденозинмонофосфат (цАМФ), был испытан у 664 взрослых (в возрасте от 18 до 75 лет) с избыточной массой тела или ожирением. У участников, допущенных к участию в исследовании, наблюдалось как минимум одно заболевание, связанное с избыточной массой тела, например, преддиабет, высокое артериальное давление, высокий уровень холестерина, жировая дистрофия печени, синдромом обструктивного апноэ сна или боли в суставах. Важно отметить, что ни у кого из них не было сахарного диабета 1 или 2 типа.
Участники получали инъекции экноглутида (1,2 мг, 1,8 мг или 2,4 мг) или плацебо один раз в неделю в течение 40 недель. Комбинированными первичными конечными точками были процентное изменение массы тела и достижение снижения массы тела ≥5%. Результаты показали более значительное снижение массы тела при применении экноглутида во всех дозах по сравнению с плацебо (таблица 1).
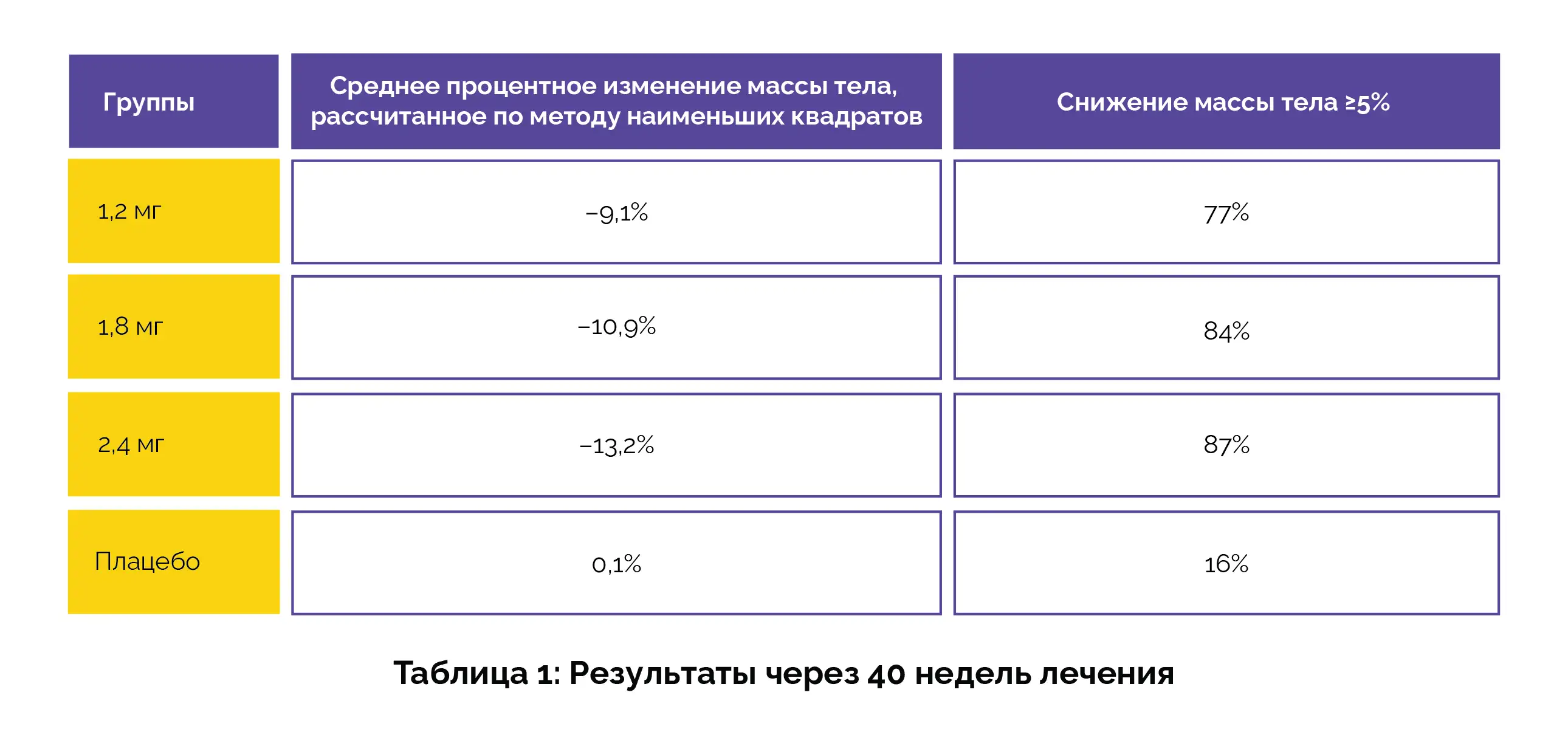
Нежелательные явления наблюдались часто, но в основном это были проблемы с желудочно-кишечным трактом легкой или средней степени тяжести. Зарегистрированные события отмечались
Только 10 пациентов прекратили терапию из-за побочных эффектов, что подчеркивает общий благоприятный профиль безопасности. Таким образом, подкожное введение экноглутида обеспечивает стойкое снижение массы тела с управляемыми побочными эффектами у взрослых пациентов с избыточной массой тела или ожирением без сахарного диабета.
The Lancet Diabetes & Endocrinology
Efficacy and safety of a biased GLP-1 receptor agonist ecnoglutide in adults with overweight or obesity: a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial
Linong Ji и соавт.
Комментарии (0)